
近期,华中科技大学同济医学院附属同济医院汪道文教授团队与华大生命科学研究院方晓东研究员团队在Signal Transduction and Targeted Therapy(IF=40.8)上发表题为“Spatiotemporal transcriptomics elucidates the pathogenesis of fulminant viral myocarditis.(时空转录组学揭示暴发性病毒性心肌炎的发病机制)”的研究。该研究利用华大时空组学(Stereo-seq)技术和单核RNA测序(snRNA-seq)技术,在CVB3病毒感染的小鼠模型中绘制出FM时空动态基因图谱。研究发现,间皮细胞是CVB3的初始靶细胞,并解析了免疫级联反应如何引爆炎症反应和心肌细胞死亡“风暴"。
欣博盛生物非常荣幸能够作为供应商为该项研究提供高品质ELISA试剂盒,为生物医学领域的科研探索贡献一份力量。
引用产品
该项研究中,使用了欣博盛生物(NeoBioscience Technology Co, Ltd)的Mouse IFN-γ ELISA Kit,用于检测FM小鼠心脏组织中相关指标的含量。
货号 | 产品名称 | 灵敏度 | 检测范围 |
QuantiCyto® Mouse IFN-γ ELISA kit (小鼠γ干扰素) | 3.9pg/ml | 7.8-500pg/ml |


研究详情
心肌炎是一种由病毒感染、自身免疫性疾病或药物毒性等多种因素引起的心肌炎症性疾病,常见于儿童和青壮年。暴发性心肌炎(Fulminant myocarditis, FM)是心肌炎中最为严重和特殊的类型,其特征为起病急骤、病情进展迅速,患者可在短时间内出现血流动力学紊乱、恶性心律失常甚至猝死。尽管现代医学在诊断和治疗方面取得了一定进展,但其复杂的病理机制仍存在诸多未解之谜。现有的研究表明,过度免疫激活引起的组织损伤在暴发性心肌炎的发生发展中发挥重要作用。传统研究方法难以全面揭示疾病的发生和发展过程,而时空转录组学(spatiotemporal transcriptomics)能够在时间和空间两个维度上解析细胞组成和基因表达的变化规律,为揭示疾病新机制提供了有力工具。
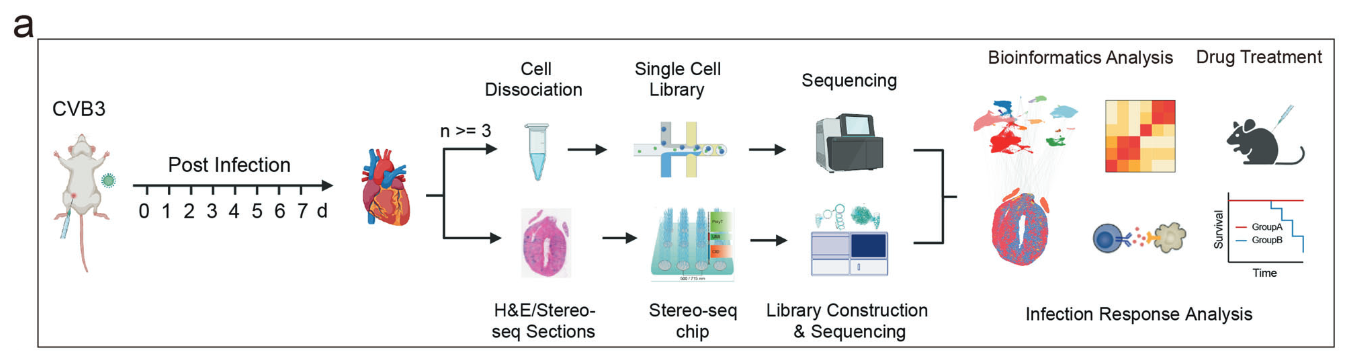
(本项研究工作流程示意图)
研究团队从A/J小鼠中提取了健康状态以及感染CVB3后1至7天(1-7 dpi)的心脏组织,并对单核RNA测序(snRNA-Seq)和时空转录组测序(Stereo-Seq)的综合数据进行了全面分析,成功构建了FM小鼠模型的时空转录景观。分析结果显示,心肌细胞的比例随时间显著降低,而巨噬细胞和T淋巴细胞等免疫细胞则呈现爆发性增长。此外,空间区域分析证实了感染区域在心肌中的显著扩张,并揭示了具有时间依赖性的转录变化特征以及细胞类型的异质性分布。
研究发现,间皮细胞在1 dpi时具有最高的CVB3水平和感染响应评分,免疫荧光染色进一步证实MLSN/CVB3共定位,触发感染过程“第一响应”。间皮细胞在感染后表达损伤相关的分子模式,与巨噬细胞上的模式识别受体结合,其释放的C3补体信号激活巨噬细胞,促进了炎症环境的形成。
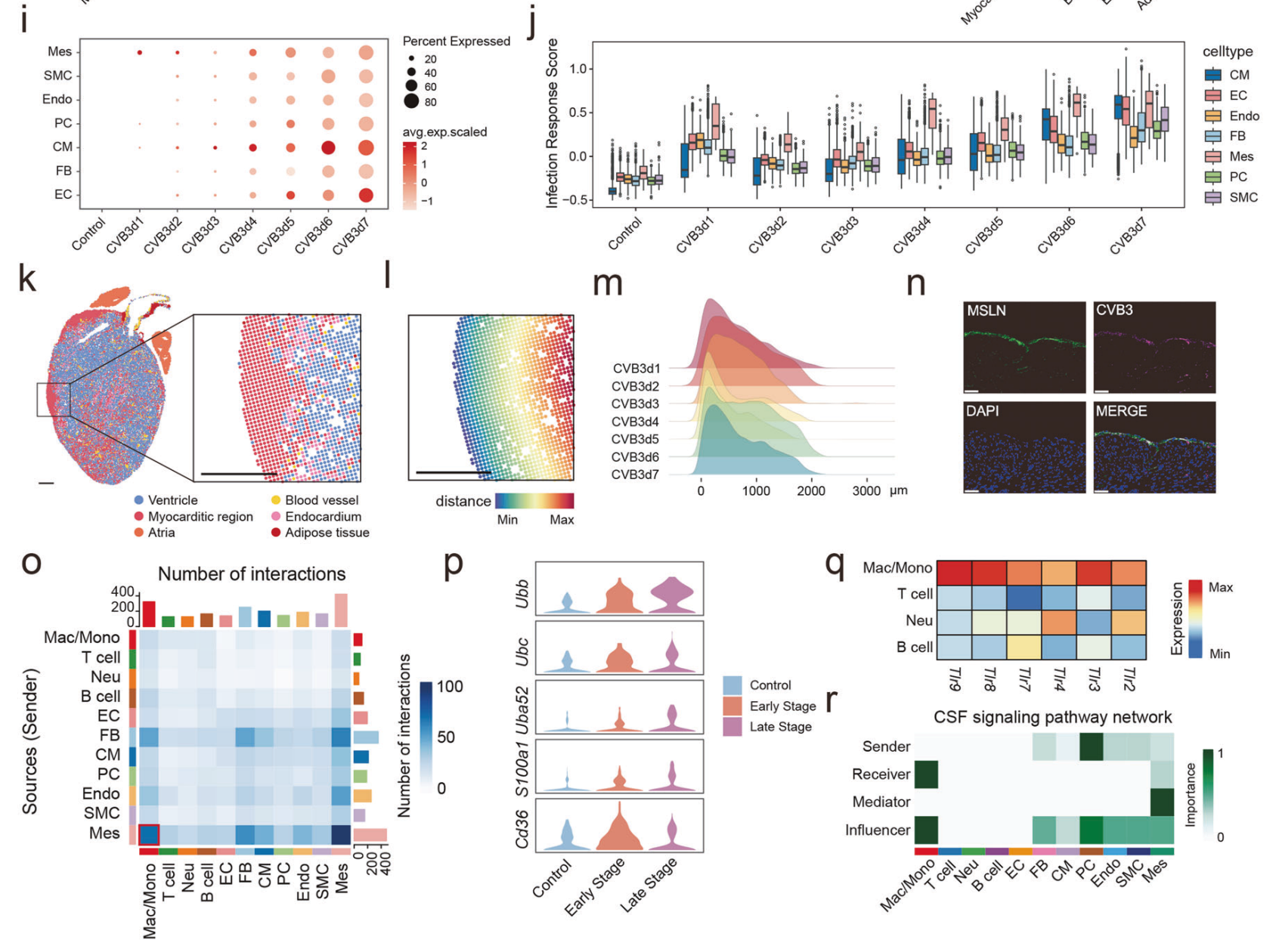
(CVB3感染心脏结构细胞和免疫细胞)
心肌细胞作为心脏的关键结构与功能细胞,在疾病进展至晚期时,未感染病毒的高死亡心肌细胞比例显著增加。以CD8+效应T细胞为主的免疫细胞浸润与心脏收缩功能在空间上呈现相互排斥的分布模式,而与细胞死亡区域共定位。这些发现提示,免疫介导的损伤可能对心肌细胞造成显著影响。CD8⁺效应T细胞通过高表达干扰素-γ(IFN-γ),诱导心肌细胞损伤。
未感染病毒的高死亡率心肌细胞主要受到转录因子Spi1的调控,该因子在FM患者的心脏中显著上调。此外,Spi1的活性与IFN-γ响应基因的表达呈高度相关性。研究显示,经Spi1抑制剂治疗的FM小鼠模型表现出死亡率显著降低、免疫细胞浸润减少以及心脏功能显著改善。这些结果表明,CD8⁺效应T细胞可通过释放IFN-γ激活Spi1,进而诱导心肌细胞死亡。
由于FM的发病机理涉及过度活化的免疫反应,因此研究团队进一步探索免疫调节药物IVIG的治疗作用。研究发现,IVIG治疗后炎症评分和病毒RNA均降低,死亡率显著下降,炎症性巨噬细胞数量和CD8+效应T细胞数量减少,IFN-γ/Spi1信号轴活性降低,这些结果证明了IVIG的有效免疫调节作用,突出了其对FM的治疗潜力。
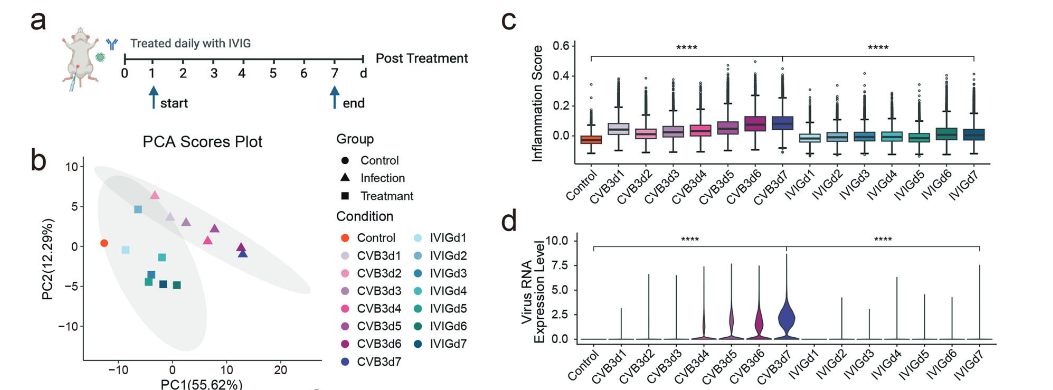
(IVIG对FM小鼠的治疗作用)
综上所述,本研究通过整合单细胞测序和空间转录组测序技术,构建了FM的全面时空图谱,揭示了其病理生理学方面的全新视角。研究确定了FM中此前未被发现的功能途径和细胞间空间相互作用,这些发现不仅为深入理解疾病的发病机制提供了详细信息,还为开发新型治疗策略奠定了坚实基础。
华中科技大学同济医学院附属同济医院汪道文教授与华大生命科学研究院方晓东研究员为本文的共同通讯作者。该工作得到了国家自然科学基金项目的资助。
文献引用
Li H, Chen X, Wang J J, et al. Spatiotemporal transcriptomics elucidates the pathogenesis of fulminant viral myocarditis[J]. Signal Transduction and Targeted Therapy, 2025, 10(1): 59.
(原文链接:https://www.nature.com/articles/s41392-025-02143-9#Sec36)


